O complemento é um dos mecanismos efetores mais importantes da resposta imune inata. Normalmente esse complemento é ativado quando um microorganismo penetra no nosso organismo. Com sua ativação, alguns componentes do complemento depositam-se sobre a superfície do patogénico responsável pela ativação, o que determina a sua destruição e/ou a sua eliminação por células do sistema fagocítico.
As atividades mais importantes de defesa do hospedeiro são efectuadas por C3 e C5. A clivagem de tais proteínas é feita por proteases altamente específicas, chamadas de convertases. Existem três C3 convertases (C4b2a, C3(H20)Bb, C3bBb) e duas C5 convertases (C4b2a3b, C3bBb3b), organizadas durante a activação das três vias do complemento, que são:
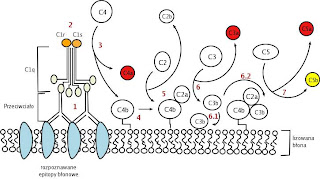
- Via Clássica: a montagem e a organização das convertases são habitualmente iniciadas por anticorpos da classe IgG ou IgM formando complexos com o antígeno. Várias outras substâncias, tais como os complexos da proteína C-reativa (PCR), determinados vírus e bactérias Gram-negativas, também podem ativar esta via. Esses ativadores são reconhecidos por C1q, uma das três proteínas do complexo C1. Esta ligação ativa C1r que ativa a pró-enzima C1s. Então, C1s ativado cliva C4, resultando na fixação covalente do seu principal fragmento, C4b, à superfície do ativador. O componente C2 liga-se a C4b e é clivado por C1 em dois fragmentos (este processo necessita da intervenção de Ca2+ o Mg2+), dos quais C2a permanece ligado a C4b, completando a montagem do complexo C4b2a, que é a C3 convertase da via clássica. Esta cliva C3 resultando na ligação de C3b à superfície do ativador e na ligação posterior de C3b à subunidade C4b2a, formando a C4b2a3b que é C5 convertase da via clássica.
- Via Alternativa: sua ativação inicia-se partir da hidrólise espontânea tiol-éster localizada na cadeia alfa do componente C3, gerando o C3(H20). Esta molécula exibe sítios reativos que permite a ligação de uma proteína plasmática, fator B (fB), formando o complexo C3(H2O)B. O fB então é clivado por uma enzima denominada fator D (fD). Esta clivagem origina 2 fragmentos Ba e Bb. O fragmento Bb fica ligado a C3(H2O), gerando o C3(H2O)Bb, que na presença de íons Mg++, tem atividade serino-protease, clivando o C3 em C3a e C3b. Assim como o C3(H2O), C3b também apresenta sítio de ligação com o fB. Formando o complexo C3bBb, após clivagem do fB pelo fD. O C3bBb atua então como C3 convertase, clivando mais moléculas de C3, formando C3bBb3b que cliva C5 em C5a e C5b. O fragmento C5b permanece ligado ao complexo e os outros componentes (C6,C7, C8 e C9) se ligam para a formação do Complexo de Ataque à Membrana (MAC).
- Via da Lectina: essa via utiliza uma proteína similar a C1q para ativar a cascata do complemento, a lectina ligadora de manose (MBL). A MBL liga-se a resíduos de manose e outros açúcares, organizados em um padrão, que recobrem superficialmente muitos patógenos. A lectina ligadora de manose é uma molécula formada por duas a seis cabeças, semelhante a C1q, que formam um complexo com duas serina proteases a MASP-1 e MASP-2. MASP-2 é similar as proteínas C1r e C1s. Quando o complexo MBL liga-se à superfície de um patógeno, MASP-2 é ativada para clivar C4, em C4a e C4b, e C2 em C2a e C2b, originando a C3 convertase da via da lectina - C4b2a. O papel de MASP-1 ainda não está bem claro na ativação do complemento.
REFERÊNCIAS
Postado por: Mônica Kallyne



Nenhum comentário:
Postar um comentário